نوشتهها
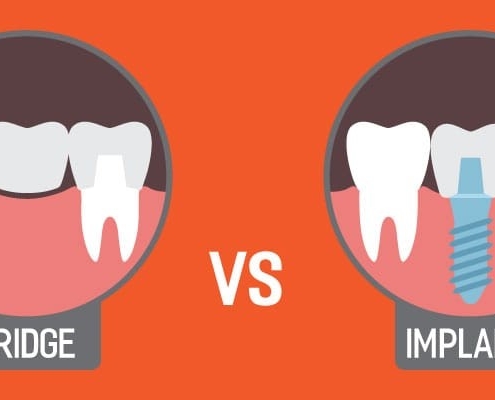
مقایسه ایمپلنت و بریج دندان
0 نظرها
/
ایمپلنت روشی با دوام برای جایگزینی دندان ها است و بهترین نتایج را از نظر زیبایی ظاهری ارائه می دهن ولی اگر در پی راهکاری فوری باشید و بخواهید از انجام جراحی بپرهیزید و کمتر هزینه کنید بریج دندان راهکار مناسبی است
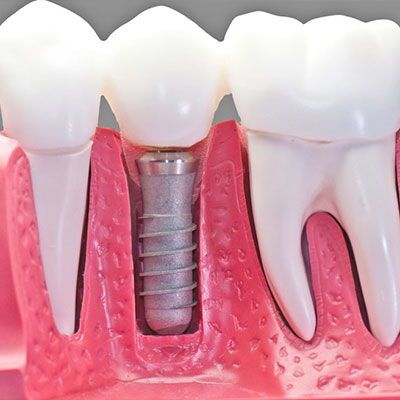
نگاهی به ایمپلنت های دندانی و دندان های طبیعی
دندان در اصل داخل فک شکل می گیرند و طی یک دسته رویداد بیولوژیک از درون مخاط روی آن بیرون می آیند ایمپلنت با جراحی داخل استخوان فک قرار داده می شوند و بدون هیچ مشکلی به داخل اپیتلیوم سطح نفوذ می کنند.
برگهها
 https://dramirbande.com/wp-content/uploads/2020/09/logo.png
0
0
دکتر امید امیربنده
https://dramirbande.com/wp-content/uploads/2020/09/logo.png
دکتر امید امیربنده2020-09-29 15:08:492020-10-04 09:09:19ایمپلنت تمام فک
https://dramirbande.com/wp-content/uploads/2020/09/logo.png
0
0
دکتر امید امیربنده
https://dramirbande.com/wp-content/uploads/2020/09/logo.png
دکتر امید امیربنده2020-09-29 15:08:492020-10-04 09:09:19ایمپلنت تمام فک https://dramirbande.com/wp-content/uploads/2020/09/logo.png
0
0
دکتر امید امیربنده
https://dramirbande.com/wp-content/uploads/2020/09/logo.png
دکتر امید امیربنده2020-09-29 08:36:322020-10-04 12:38:15ایمپلنت
https://dramirbande.com/wp-content/uploads/2020/09/logo.png
0
0
دکتر امید امیربنده
https://dramirbande.com/wp-content/uploads/2020/09/logo.png
دکتر امید امیربنده2020-09-29 08:36:322020-10-04 12:38:15ایمپلنت https://dramirbande.com/wp-content/uploads/2020/10/photo_2020-04-07_13-25-52_b04b1ad77f75b9e71c71bd04a7287649.jpg
640
640
دکتر امید امیربنده
https://dramirbande.com/wp-content/uploads/2020/09/logo.png
دکتر امید امیربنده2015-10-15 14:50:552024-11-15 00:27:22خانه
https://dramirbande.com/wp-content/uploads/2020/10/photo_2020-04-07_13-25-52_b04b1ad77f75b9e71c71bd04a7287649.jpg
640
640
دکتر امید امیربنده
https://dramirbande.com/wp-content/uploads/2020/09/logo.png
دکتر امید امیربنده2015-10-15 14:50:552024-11-15 00:27:22خانه